题目内容:
某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。(1)该反应的离子方程式为________________________。
(2)提出合理假设。该实验中反应速率明显加快的原因可能是_____________________。
A.反应放热导致温度升高 B.压强增大 C.生成物的催化作用 D.反应物接触面积增大
(3)初步探究。测定反应过程中溶液不同时间的温度,结果如下表
 结合实验目的和表中数据,你得出的结论是__________________________________。
结合实验目的和表中数据,你得出的结论是__________________________________。(4)进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请完成以下实验设计表并将实验目的补充完整
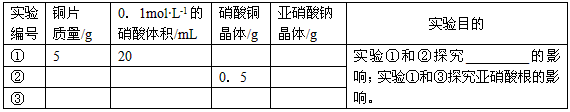
参考答案:
