题目内容:
如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题
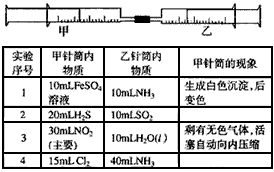 (1)实验1中,颜色变化为___________,写出沉淀变色的化学方程式:______________________。
(1)实验1中,颜色变化为___________,写出沉淀变色的化学方程式:______________________。 (2)实验2甲针筒内的现象是:有___________生成,活塞________移动(填向外、向内、不)。
(3)实验3中,甲中的3mL气体是NO2气体,那么甲中最后剩余的无色气体是______________________,写出NO2与H2O的反应中氧化剂和还原剂的物质的量之比为______________________。
(4)实验4中,已知:3Cl2+2NH3==N2+6HCl。甲针筒处活塞有移动,针筒内除有白烟产生外,气体的颜色变为__________________。最后针筒内剩余气体的体积约为________mL。
参考答案:
