题目内容:
(8分)已知25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):①硫酸溶液
②硫酸氢钠溶液
③醋酸溶液
④盐酸
HSO4-
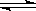 H++SO42—
H++SO42—HSO4-
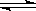 H++SO42-
H++SO42-CH3COOH
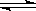 CH3COO-+H+
CH3COO-+H+HCl = H++Cl-
10℅
29℅
1.33℅
100℅
⑴根据题意,请写出向硫酸溶液中滴加足量氢氧化钡溶液反应的离子反应方程式
⑵25℃时,0.1mol/L上述几种溶液中C(H+)由大到小的顺序是(填序号,下同);
⑶25℃时,将足量锌粉放入等体积pH=1的上述几种溶液中,产生H2的体积(相同状况)由大到小的顺序是;
⑷25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是:
参考答案:
