题目内容:
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃导管口处缠放一团蘸有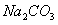 溶液的棉花。给试管加热,观察现象。当试管中的液体逐渐透明时,停止加热。回答下列问题:
溶液的棉花。给试管加热,观察现象。当试管中的液体逐渐透明时,停止加热。回答下列问题:
 (1)写出a处反应的化学方程式________________________________________________ 。
(1)写出a处反应的化学方程式________________________________________________ 。(2)试管中的液体反应一段时间后,处滤纸条的变化为_______________________________________ 。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为______________________________。
(3)待试管中的液体冷却后,将试管上层液体倒去,再慢慢加入少量水,可观察溶液呈__________色。
(4)玻璃导管口处缠放一团蘸有
 溶液的棉花所起的作用是_______________________ ,反应的方程式________________________________________ 。
溶液的棉花所起的作用是_______________________ ,反应的方程式________________________________________ 。(5)如果浓硫酸的浓度为
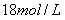 ,铜片是过量的,加热使之反应,当被还原的硫酸为
,铜片是过量的,加热使之反应,当被还原的硫酸为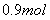 。则浓硫酸的实际体积_____ (填写“大于”、“等于”或“小于”)
。则浓硫酸的实际体积_____ (填写“大于”、“等于”或“小于”) 。
。
参考答案:
