题目内容:
在量热计(如下图所示)中将l00cm3、0. 500mol·L-1 CH3COOH溶液与100cm3、0. 500mol·L-1 NaOH溶液混合,温度从298.16K升高到300. 71K。已知量热计的热容常数(量热计各部件每升高1K所需的热量)是150. 5J·K-1,CH3COONa溶液比热容为4.03J·g-1·K-1,溶液的密度为0. 963g·cm-3。
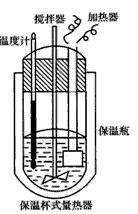 (1)试求CH3COOH的中和反应的反应热△H为____kJ·mol-1。
(1)试求CH3COOH的中和反应的反应热△H为____kJ·mol-1。 (2)CH3COOH的中和热的文献值为56. 1kJ·mol-1,请你分析(1)中测得的实验值偏差的可能原因是____。
(3)已知HCl( aq) +NaOH (aq)=NaCl(aq) +H2O(l) △H=- 57. 3kJ.mol-1;现有①CH3COOH、②浓H2SO4、
③HNO3与NaOH溶液反应的反应热分别为 △H1、△H2、△H3,则△H1、△H2、△H3三者的大小关系为___。
参考答案:
