题目内容:
氮及其化合物在生产、生活中有重要的作用。(1)NH3是制碱工业中不可缺少的重要物质。继侯德榜“联合制碱法”后,上世纪50年代某些化工专家开始研究有机胺制碱法,其工艺流程如下:
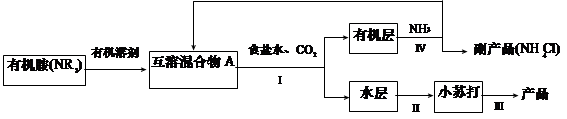
已知:NR3 + CO2 + NaCl + H2O = NaHCO3 + NR3·HCl
NR3 + HCl = NR3·HCl,且NR3·HCl 易溶于有机溶剂。
①操作Ⅰ名称为;
②某实验小组同学查阅资料知,有机溶剂和有机胺沸点差别较大,现欲将A中各成分进行分离,请写出除了导管、酒精灯、牛角管、锥形瓶外,该分离操作所需的玻璃仪器名称 ;
(2)N2在化工生产、农业、医疗、航天航空等领域用途广泛。现提供以下装置(连接仪器略去):
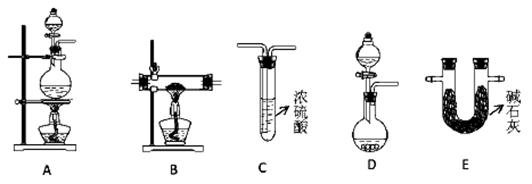
①某化学兴趣小组甲同学欲用加热NaNO2 和NH4Cl的浓溶液制得N2,应该选择的发生装置是,检验该发生装置气密性的操作为 ;
②在加热条件下,用NH3 还原CuO可制得N2,同时获得铜粉,此反应的化学方应方程式是。乙同学用此法制得干燥、纯净的N2,且需要的NH3 以生石灰和浓氨水作原料。按气流从左到右,整套装置的连接顺序是(填写字母序号);最后一个装置中试剂的作用是;
参考答案:
