题目内容:
无水FeCl3呈棕红色,极易潮解,100℃左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。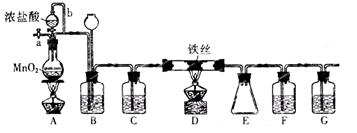
请回答:
(1)装置A中反应的离子方程式为。
(2)装置F中所加的试剂为。
(3)导管b的作用为;
装置B的作用为。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为。
(5)反应结束后,拆卸装置前,必须进行的操作是
(6)为检验所得产品中是否含有FeCl2,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入一种试剂,该试剂为(填序号)。
①Fe粉②KSCN溶液③酸性KMnO4溶液 ④NaOH溶液
参考答案:
