题目内容:
.(10扬州27). (15分)叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.【应用研究】
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为_______。
【制备研究】
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH3+N2O = NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润________。
【Na2CO3质量分数测定】
工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体)。
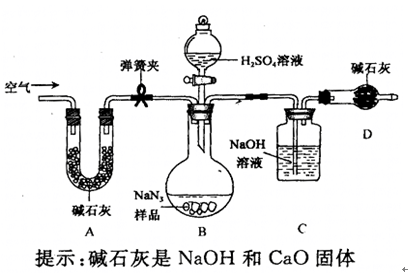
(3)装置A的作用是_____。设计的实验步骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,_______;⑤再次称量装置C。计算碳酸钠含量至少需要测定______(填数字)个数据。根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因_______。
【NaN3纯度测定】精确称量0.140 g NaN3样品,设计如图装置,测定其纯度。已知
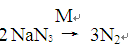 (NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。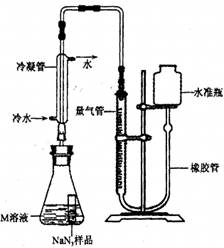
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差_____(填“变大”、“变小”或“不变”),说明气密性良好。
(5)使小试管中的NaN3样品与M溶液接触的操作是______。
(6)使用冷水冷凝的目的是______。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是_______。
(7)常温下测得量气管读数为67.2 mL(N2的密度为1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算NaN3样品的纯度(写出计算过程)。
参考答案:
